Ética en ensayos clínicos de Dermatología
Main Article Content
Abstract
Cuando el comportamiento no ético se vuelve parte de lo cotidiano
Estimado editor:
Quiero hacerlo partícipe a usted y los lectores de la revista sobre estas reflexiones.
A nuestros pacientes les gustaría tener la certeza de que el comportamiento en la investigación científica siempre es ético. Sin embargo, la manera de realizar investigación científica cambia cuando la fuente de financiamiento es una organización privada (por ejemplo, las farmacéuticas) o cuando los recursos financieros los provee una organización pública.1
A finales del decenio de 1990, la Dra. Nancy Olivieri, durante un proyecto de investigación, descubrió riesgos asociados con el fármaco que investigaba y publicó unos resultados preliminares. La compañía que financiaba el proyecto la censuró, le quitó el financiamiento, canceló su proyecto y la demandó. Todo esto mientras la universidad donde laboraba la despidió.1
Otro caso fue el de un investigador que, al colaborar con una compañía, se dio cuenta de las grandes limitaciones que se le imponían al impedir la corroboración de los resultados obtenidos en la compañía porque ellos lo consideraban innecesario para su negocio y dichos resultados no debían ser cuestionados.1 Cuando un científico escucha de otros científicos que lo cotidiano es esconder las pruebas para verificar resultados, pueden tomarse dos rutas: contaminarse con esa conducta o, bien, rechazar que el comportamiento no ético pueda aceptarse como cotidiano.
Un metanálisis en el que se compararon los resultados de eficacia reportados por estudios financiados por la industria farmacéutica versus otras instituciones públicas concluyeron que los estudios de la industria farmacéutica tenían resultados positivos de eficacia y conclusiones favorables con mayor frecuencia que los obtenidos por las instituciones públicas. En tres artículos que examinaron 154 estudios financiados por la industria encontraron que era mucho más probable que los estudios pagados por la compañía que manufacturaba el tratamiento estudiado favorecieran el fármaco sobre el control.2
La Agencia Internacional de Investigación en Cáncer de la ONU (IARC) en 2009 clasificó al talco que contenía fibras de asbestos como carcinogénico. En 2010 la Sociedad de Cáncer Estadounidense refirió que el uso de talco perineal es posiblemente carcinogénico en los seres humanos. Posteriormente, se descubrió que el carcinoma seroso del ovario podía haber aumentado en un 30% con la aplicación perineal de talco. El carcinoma seroso es la forma de cáncer de ovario asociada más consistentemente con el asbesto.3 Los estudios de Johnson and Johnson (J&J) desde 1950 demostraron la presencia de asbestos en sus productos de talco.3 Sin embargo, J&J no menciona el riesgo de cáncer de ovario en sus productos, mientras otras empresas (como Angel of Mine, Perfect Purity y Assured Body and Foot Powders) sí lo reportan en sus cosméticos. No hay tasas de cuántas personas han sido afectadas por exposición a talco, pero en Estados Unidos se han registrado unos 40,000 casos legales contra Johnson and Johnson.4
La Dermatología también está afectada por las contribuciones económicas que efectúan las compañías farmacéuticas. En la realización de las Guías de práctica clínica en Dermatología en Japón, el 90.6% de sus autores recibió al menos un pago económico proveniente de una compañía farmacéutica. En Estados Unidos el 81.6% de los autores de sus guías recibió también, cuando menos, una contribución monetaria.5 Es en el curso de negociar esos pagos que el comportamiento no ético se desempeña si en las guías se recomienda el uso de los productos que fabrican las compañías farmacéuticas patrocinadoras.
Un modelo de financiamiento que facilita el comportamiento ético
En 2015 la Sociedad Internacional para Profesionales de Publicación Médica creó un comité entre sus miembros para actualizar las Buenas Prácticas de Publicación para Comunicar Investigaciones Patrocinadas por Empresas (Good Publication Practice for Communicating Company-Sponsored Research) y publicar la tercera guía. Los puntos favorables que recomienda esta guía son la publicación de hallazgos positivos y negativos, la colaboración y la publicación de hallazgos no aceptados por una revista en un sitio web público.6 Sin embargo, esta guía no habla de quién debería tener el poder de decisión sobre cuáles investigaciones se harán y cuáles variables se estudiarán.
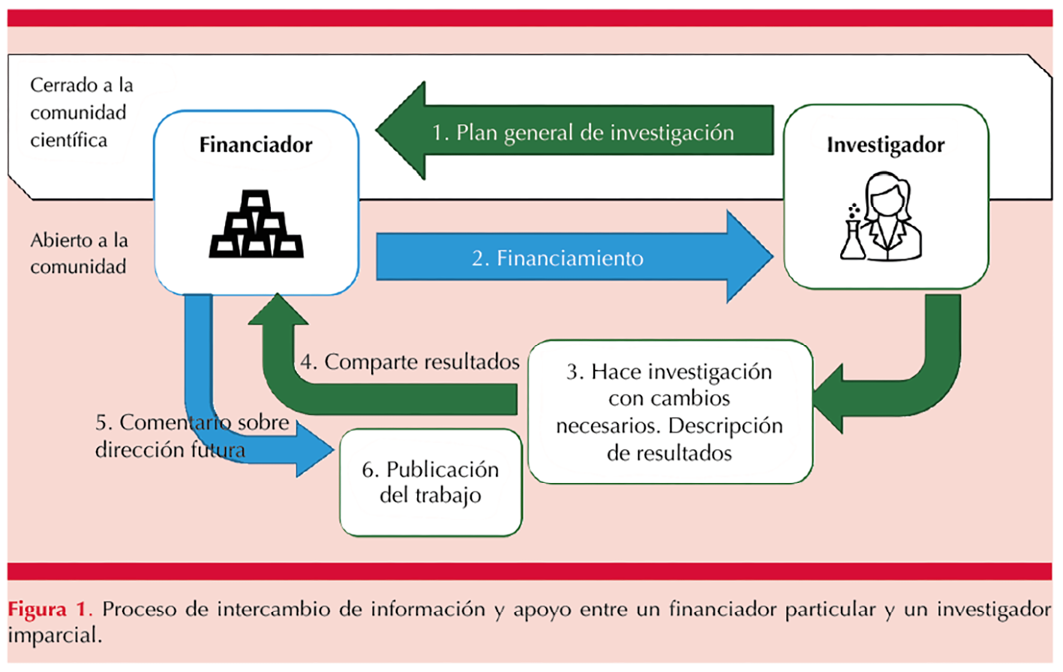
La Figura 1 representa la propuesta de un proceso más ético del intercambio entre financiador particular de un estudio y un(a) investigador(a) imparcial. Los conflictos de interés de las y los autores de un artículo y la fuente de financiamiento deben declararse al inicio, no al final. Todos los estudios financiados y desempeñados por el mismo financiador deben declarar esto para que los lectores tomen en cuenta este aspecto antes de leer los resultados. Todas las investigaciones deberían hacerse con un protocolo que especifique los objetivos y metas sin que el financiador intervenga en el procedimiento del proyecto y en los resultados. Estos resultados (positivos o negativos) deben ser dados a conocer y no serían modificables ni sujetos a suspensión por el patrocinador. Con este sistema los resultados intermedios no serían confidenciales. En resumen: el o la investigadora deberían llevar a cabo la investigación de manera abierta, dar a conocer resultados intermedios y hacer los cambios necesarios sin la influencia del financiador. Antes de la publicación, el o la investigadora puede compartir los resultados en una reunión abierta con el financiador. Y éste podría hacer comentarios, igual abiertos al público general, sobre la dirección futura de la investigación antes de que salga a la luz la publicación.
Conclusión: hacia una industria de la medicina con la confianza de la comunidad científica
Este texto no pretende deletrear la forma de implementar estas sugerencias, ya que van a variar según el país y los recursos disponibles, pero sí poner el tema a discusión y ofrecer estas sugerencias. Puede ser que en algunos países las reuniones públicas se lleven a cabo en un edificio gubernamental, mientras en otros una reunión en línea pública y abierta es lo adecuado. Una crítica de este sistema podría ser que el público general no entendería los datos públicos y menos los intermedios. En lo que sí puede confiarse es que alguien interpretará los datos publicados para la gente con menos conocimiento del tema.
Al tener un proceso más público se generará más confianza entre el público, el sistema de salud y la industria farmacéutica. Hay que cambiar la idea de que no se pueden publicar resultados intermedios por la confidencialidad. Esto generará un cambio en las leyes de derecho de autor para que pueda obtenerse el derecho de autor de datos y de la innovación médica con algo ya en el ámbito público.
Con información más transparente, el público, médicos y científicos pueden confiar más en los ensayos clínicos.